
Desarrollado para obtener una respuesta
LYTGOBI demostró una tasa de respuesta objetiva (TRO) del 42 % en pacientes con CCi localmente avanzado o metastásico previamente tratados1
TRO: 42 %

Mediana del tiempo hasta la respuesta de 2,5 meses (intervalo: 0,7-7,4)
La TRO con LYTGOBI fue del
42 %
(IC del 95 %: 32 %, 52 %)
RP: 42 %
Los pacientes experimentaron una mediana de la duración de la respuesta (mDdR) de casi 10 meses con LYTGOBI1
Mediana de la DdR
9,7
Meses
(IC del 95 %: 7,6, 17,1)


Median DoR
9.7
Months
(95% CI: 7.6-17.1)
| Estimaciones de Kaplan-Meier de la mDdR (IC del 95 %) | |
|---|---|
| 3 meses | 100 % (100; 100) |
| 6 meses | 85,1 % (69,8; 93,1) |
| 9 meses | 52,8 % (34,2; 68,3) |
| 12 meses | 37,0 % (18,4; 55,7) |
FOENIX-CCA2: Otros criterios de valoración
LYTGOBI recibió la autorización de comercialización condicional de la Agencia Europea de Medicamentos1,2
- Esto significa que se esperan más pruebas para confirmar la eficacia y la seguridad de este medicamento1
Supervivencia sin progresión (SSP)2
Estimación de Kaplan-Meier de la SSP (N = 103)
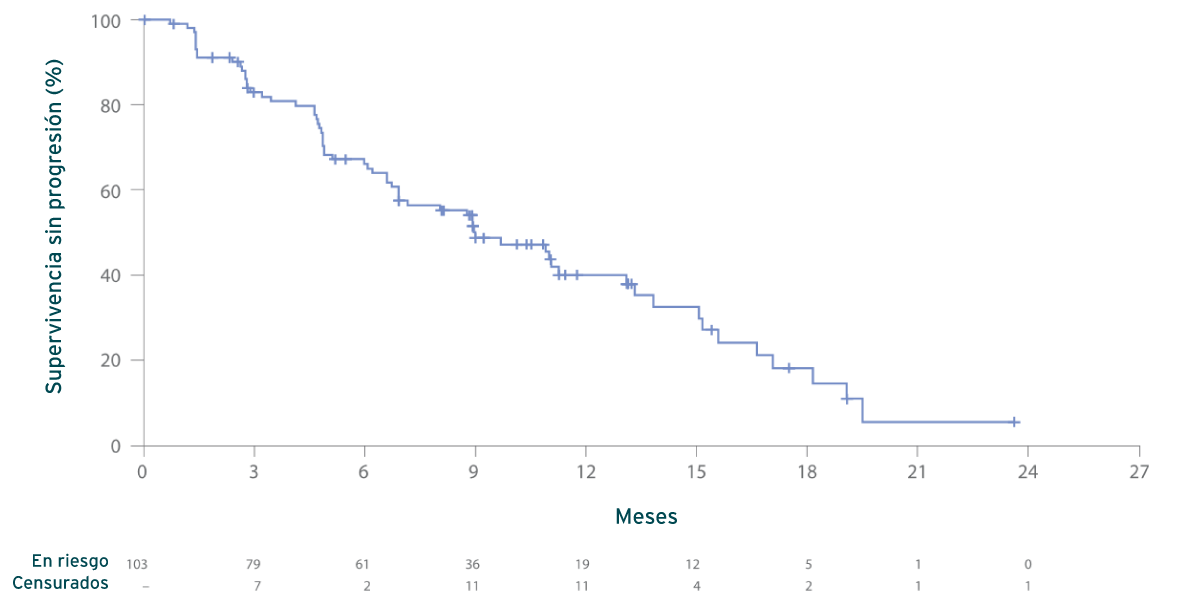
Mediana, 9,0 m (IC del 95 %: 6,9, 13,1)
- La mediana del seguimiento en el momento del corte de los datos era de 17,1 meses
Supervivencia global (SG)2
Estimación de Kaplan-Meier de la SG (N = 103)
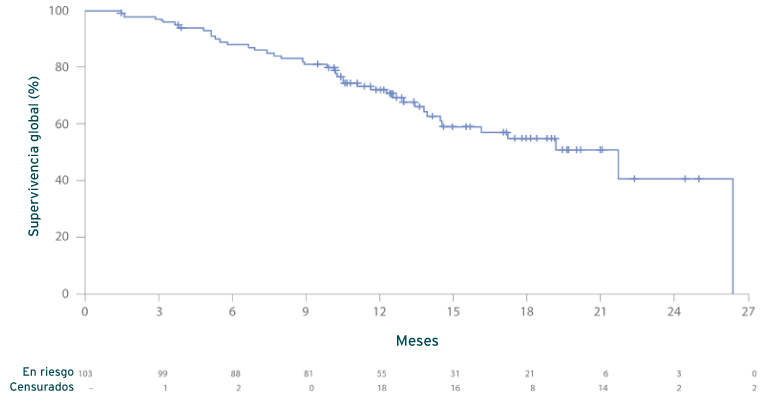
Mediana, 21,7 m (IC del 95 %: 14,5, no alcanzado)
- En el momento del corte de los datos (1 Oct., 2020): La mediana del seguimiento era de 17,1 meses; los datos de la SG no eran definitivos; 40 pacientes murieron. Todos los pacientes habían interrumpido el tratamiento antes de su muerte, siendo el motivo predominante de la interrupción la progresión de la enfermedad en el 90 % de los pacientes.2
- El análisis maduro con una mediana de seguimiento de 25,0 meses (29 May, 2021) arrojó una mediana de la SG de 20,0 meses (IC del 95 %: 16,4-24,6 %)2
Tasa de control de la enfermedad (TCE) (n = 85)2

- FOENIX-CCA2 fue un estudio de un solo grupo2
- En este contexto, los resultados de la TCE pueden ser reflejo de la evolución espontánea del colangiocarcinoma en un paciente concreto, en lugar del efecto directo del tratamiento
- *La TCE es la suma de respuesta completa, respuesta parcial y enfermedad estable.
Resultados complementarios
Resultados de eficacia en el seguimiento ampliado
En un análisis de seguimiento no especificado previamente que se realizó 8 meses después del análisis principal (fecha de corte de los datos, 29 de mayo de 2021; mediana de seguimiento, 25,0 meses), se mantuvo la eficacia en la población global del estudio con.2
- TRO del 41,7 % con IC del 95 %, del 32,1 % al 51,9 %
- TCE del 82,5 % con IC del 95 %, del 73,8 % al 89,3 %
- mediana de la DdR de 9,5 meses con IC del 95 %, de 7,6 a 10,4
- mediana de la SSP de 8,9 meses con IC del 95 %, de 6,7 a 11,0
- mediana de la SG de 20,0 meses con IC del 95 %, de 16,4 a 24,6
CCi = colangiocarcinoma intrahepático; DdR = duración de la respuesta; IC = intervalo de confianza; m = meses; RP = respuesta parcial ; SG = supervivencia global ; SSP = supervivencia sin progression ; TCE = tasa de control de la enfermedad TRO = tasa de respuesta objetiva.
Referencias:
Resumen de las características del producto de LYTGOBI®. www.lytgobi.eu/es/smpc
2.Goyal L, et al. Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma. N Engl J Med. 2023;388:228—239.


